оригинал: Русский медицинский журнал
Подагра: мистификация в стиле Гудини
Статья посвящена вопросам диагностики и лечения подагры
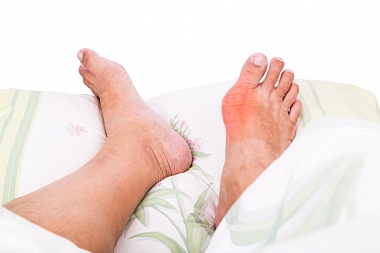 Подагра – системное тофусное заболевание, характеризующееся отложением кристаллов моноурата натрия (МУН) в различных тканях и развивающимся в связи с этим воспалением, у лиц с гиперурикемией (ГУ), обусловленной внешне-средовыми и/или генетическими факторами.
Подагра – системное тофусное заболевание, характеризующееся отложением кристаллов моноурата натрия (МУН) в различных тканях и развивающимся в связи с этим воспалением, у лиц с гиперурикемией (ГУ), обусловленной внешне-средовыми и/или генетическими факторами.
Подагре можно смело присвоить титул самого известного заболевания в истории ревматологии. Упоминание о ней встречается во множестве врачебных рукописей со времен Гиппократа. Авиценна в своем трактате «О подагре» писал: «И пронзает ногу пациента боль, удару молнии подобная». Первое клиническое описание острой подагрической атаки принадлежит английскому врачу Сиденгаму, описавшему свои собственные страдания: «Я ложусь спать без боли и засыпаю хорошо, но глубокой ночью будит меня боль, охватывающая либо большой палец ноги, либо лодыжку, либо икроножную мышцу. Такое впечатление, что такая же боль бывает при смещении костей, ощущается озноб и дрожь во всем теле, за которыми следует лихорадочное состояние». Классическую подагрическую атаку описывает в известном романе «Похождения бравого солдата Швейка» Ярослав Гашек: «Его палец, который до сих пор вел себя смирно, из тихого и спокойного агнца превратился в ревущего тигра, в электрический ток в шестьсот вольт, в палец, каждую косточку которого молот медленно дробит в щебень».
Эпидемиологические данные свидетельствуют о непрерывном росте заболеваемости подагрой в последние несколько десятилетий. Чаще в сравнении с женщинами (7:1) болеют мужчины в возрасте старше 40 лет. В последние годы отмечается увеличение частоты женской и семейной подагры, нефролитиаза, а также некоторых характерных для больных подагрой коморбидных состояний: ожирения, артериальной гипертензии, ишемической болезни сердца.
Несмотря на многочисленные описания острой подагрической атаки, подагра способна удивить нетривиальным вариантом дебюта заболевания и разнообразием клинических проявлений, требующих проведения дифференциальной диагностики с широким спектром заболеваний.
О подобных «мистификациях» подагры и пойдет речь в нижеописанном клиническом случае.
Больной Р., 63 года, поступил в отделение гнойной хирургии Курской областной клинической больницы с жалобами на интенсивные боли режущего характера, с преимущественной локализацией в нижнем эпигастрии, подвздошных областях, значительно усиливающиеся после приема пищи, повышение температуры до 40 °C, повышение АД до 200 и 120 мм рт. ст., потерю массы тела на 10 кг в течение 1,5 мес.
Из анамнеза установлено, что пациент в течение 3-х лет страдает артериальной гипертензией (разброс цифр АД: САД – 150–220 мм рт. ст., ДАД – 100–120 мм рт. ст.). Повышение уровня АД всегда вызывало появление у пациента клинической симптоматики в виде головных болей, головокружения, неприятных ощущений в области сердца, перебоев в его работе. Неоднократно обращался за медицинской помощью к кардиологу. Пациенту был назначен метопролол в дозе 150 мг/сут.
Через 5 дней пациент почувствовал перебои в работе сердца (ощущение «остановки сердца в груди»), резкое похолодание нижних конечностей (летом на рабочем месте находился исключительно с включенным обогревателем).
Пациент проинформировал врача о своих проблемах, по данным медицинской документации, при оценке пульса и АД было выявлено наличие брадикардии (ЧСС=38 уд./мин) при отсутствии достижения целевых значений АД (АД 150/100 мм рт. ст.).
Коррекции антигипертензивной терапии не проводилось.
Пациент самостоятельно прекратил прием метопролола и обратился за медицинской помощью к другому врачу.
При обследовании вновь было выявлено повышение АД – 185/110 мм рт. ст., наличие гиперхолестеринемии – 7,5 ммоль/л, гиперурикемии – 540 мкмоль/л. Пациенту была рекомендована комбинированная терапия – фиксированная комбинация периндоприла и индапамида.
В течение 2-х нед. приема вышеуказанной комбинации нормализации АД пациентом отмечено не было, в связи с чем он принял решение лечиться самостоятельно.
Начал прием гипотензивного препарата по совету провизора (фиксированная комбинация атенолола и хлорталидона). Через 3 мес. регулярного приема данного препарата АД стабилизировалось (АД 130/80 мм рт. ст.), однако с течением времени после приема пищи пациент стал отмечать появление тянущих болей в животе, тошноты, в связи с чем стал воздерживаться от еды. Боли в животе усиливались, появилась лихорадка 38–38,6 °С, постоянно беспокоила тошнота. Затем болевой синдром в животе стал нестерпимым, и пациент был доставлен машиной скорой помощи в приемное отделение областной клинической больницы.
Объективно: общее состояние тяжелое. Кожные покровы бледные, акроцианоз, пастозность голеней и стоп. Дыхание в легких везикулярное, хрипов нет. Тоны сердца звучные, ритм правильный, тахикардия. ЧСС=110/мин. Акцент II тона на аорте, выслушивался систолический шум над аортой. АД 200/120 мм рт. ст. Живот резко болезненный при пальпации во всех отделах. Температура тела 40 °С.
В общем анализе крови имели место лейкоцитоз до 18×109/л, увеличение СОЭ до 65 мм/ч, в биохимическом анализе крови отмечено повышение уровня СРБ до 60 г/л, уровня креатинина до 248 мкмоль/л. Уровень мочевой кислоты (МК) в крови составил 880 мкмоль/л.
В общем анализе мочи – ураты покрывают все поле зрения.
При дуплексном сканировании дуги аорты, ее восходящего и нисходящего отделов, сонных артерий были выявлены признаки атеросклеротического поражения артерий.
При УЗИ патологии органов брюшной полости не выявлено; почки – солевая инкрустация, пирамидки отечны.
При эхокардиографии: клапанный аппарат не изменен, гипертрофия миокарда левого желудочка, стенки аорты уплотнены за счет атеросклероза.
С учетом наличия клинических признаков перитонита, с целью верификации диагноза консилиум хирургов принял решение о проведении лапароскопии.
Согласно протоколу исследования в брюшной полости пациента были выявлены небольшое количество свободной жидкости, признаки воспаления париетальной и висцеральной брюшины.
В процессе исследования для проведения цитологического анализа был осуществлен забор 10 мл жидкости из брюшной полости. При проведении поляризационной микроскопии были визуализированы многочисленные кристаллы игольчатой формы, покрывающие все поле зрения.
Можем ли мы верифицировать диагноз подагрической атаки у пациента на основании имеющихся в нашем распоряжении данных? Для ответа на этот вопрос стоит обратиться к рекомендациям по диагностике подагры EULAR 2014.
Итак, пункт 1 рекомендаций гласит: идентификация кристаллов должна быть выполнена для установления определенного диагноза подагры; если это невозможно, диагноз подагры может быть подтвержден наличием классических клинических признаков (таких как острый артрит I плюсне-фалангового сустава, тофусы, быстрый ответ на колхицин) и/или выявлением характерных признаков при томографии. Уровень доказательности – 2b, уровень согласия – 8,8 (SD 1,6).
Первая часть этого пункта не оставляет каких-либо сомнений, с учетом того, что идентификация кристаллов МУН – общепризнанный «золотой стандарт» диагностики подагры, и быть абсолютно уверенным в ее диагнозе можно только в случае их выявления
Таким образом, в соответствии с международными рекомендациями по диагностике подагры, на основании анализа клинических данных, результатов дополнительных методов исследования был верифицирован диагноз: подагра, подагрическая атака, гиперурикемия, абдоминальный синдром, лихорадка, лейкоцитоз, мочекислая нефропатия, ХБП-1. Артериальная гипертония III ст., риск 3. Гипертрофия миокарда левого желудочка. НК IIА, ФК 2.
Разумеется, вопрос тактики лечения у подобного пациента вызывал определенные опасения ввиду особой локализации подагрической атаки.
Рекомендации EULAR 2014 по лечению подагры предполагают определение прежде всего факторов риска и коморбидности для решения вопроса о тактике ведения пациента.
У пациентов с подагрой и/или ГУ должна быть определена почечная функция, рекомендуется оценка факторов кардиоваскулярного риска. Уровень доказательности – 2с, уровень согласия – 8,4 (SD 2,1) [2].
Ценность этой рекомендации основана на данных множества крупных исследований. Установлено, что относительный риск развития подагры у больных с хронической болезнью почек (ХБП) значительно выше популяционного [3], наличие ГУ является одним из факторов риска развития терминальной почечной недостаточности [3], а смертность у больных с ХБП при наличии подагры увеличивается более чем в 4 раза [4]. Необходимость коррекции дозы при назначении пациентам с подагрой аллопуринола, НПВП, колхицина предусматривает мониторинг скорости клубочковой фильтрации.
Не менее важной представляется обязательная оценка факторов кардиоваскулярного риска, частота выявления которых при подагре очень высока [5, 6], что обусловливает высокий уровень кардиоваскулярной смертности у больных подагрой [7].
Что касается данного пациента, то очевидно, что бесконтрольный прием диуретиков, вызванный полным отсутствием комплаентности, стал основой для поддержания ГУ у коморбидного пациента и развития подагрической атаки на фоне депонирования кристаллов МУН в брюшной полости.
Тактика купирования подагрической атаки подобной локализации между тем вполне может быть основана на положении рекомендации EULAR 2014, гласящей:
«При остром приступе подагры следует назначать низкие дозы колхицина (до 2 мг в день), НПВП и/или ГК (внутрисуставно, перорально или внутримышечно в зависимости от сопутствующих заболеваний и риска неблагоприятных реакций). Уровень доказательности – 1b, уровень согласия – 8,9 (SD2,1)» [4].
С учетом поражения ЖКТ от применения пероральных форм лекарственных препаратов было решено воздержаться.
Для купирования острой подагрической атаки с учетом тяжести состояния больного была применена инфузионная терапия с использованием метилпреднизолона по 250 мг внутривенно капельно в течение 3 дней, с тщательным мониторингом артериального давления и гастропротекцией.
На фоне проводимой терапии у пациента прекратились боли в животе, температура тела нормализовалась.
Предстояло решить вопрос о назначении уратснижающей терапии с учетом особенностей дебюта заболевания и высоких значений уровня МК.
Согласно рекомендациям EULAR, пациентам следует рекомендовать здоровый образ жизни, включая снижение избыточной массы тела, регулярное выполнение физических упражнений, отказ от курения, излишнего приема алкоголя и подслащенных сахаром напитков. Уровень доказательности – 5, уровень согласия – 8,5 (SD 1,7).
Аллопуринол должен быть препаратом первой линии уратснижающей терапии; в качестве альтернативы могут использоваться урикозурики (например, бензбромарон, пробенецид) или фебуксостат; уриказа в качестве монотерапии должна рассматриваться только у больных с тяжелой подагрой, у которых все другие формы терапии не эффективны или противопоказаны. Уровень доказательности – 2b, уровень согласия – 9,1 (SD 1,3).
Цель лечения – сывороточный уровень МК<0,36 ммоль/л (6 мг/дл), отсутствие атак подагрического артрита и рассасывание тофусов. Мониторинг должен включать контроль сывороточного уровня МК, частоты приступов артрита и размеров тофусов. Уровень доказательности – 2b, уровень согласия – 9,0 (SD 1,8).
Титрация дозы аллопуринола у данного пациента проводилась начиная со 100 мг/сут, с последующей эскалацией дозы на 100 мг 1 раз в 10 дней, под контролем уровня МК в крови, вплоть до достижения целевых значений, и в итоге составила 500 мг/сут. На фоне титрации дозы аллопуринола пациент стал отмечать появление эпизодических болей в правом голеностопном суставе, с развитием дефигурации сустава, гипертермией кожи над ним, что послужило основанием для назначения сопутствующей терапии с применением НПВП.
С учетом предшествующего поражения ЖКТ препаратом выбора в купировании явлений артрита стал амтолметин гуацил (АМГ) (Найзилат), к основным преимуществам которого относится влияние на активность оксида азота (NO) в слизистой оболочке пищеварительного тракта [8, 9].
Согласно имеющимся литературным данным, Найзилат обладает лучшей переносимостью в сравнении с другими НПВП (диклофенак, индометацин, напроксен, ибупрофен и др.). Установлено, что частота нежелательных лекарственных реакций и раннего прекращения лечения значительно ниже у пациентов, которые принимали АМГ, чем другие НПВП. Частота и степень тяжести поражения слизистой оболочки желудка, по результатам эндоскопии, были меньше при приеме АМГ по сравнению с другими НПВП. В дополнение можно отметить, что для АМГ были продемонстрированы гастропротективные свойства в отношении повреждающего действия других НПВП [10]. По данным исследования «КОРОНА» (эффективность и кардиоваскулярная безопасность амтолметин гуацила в лечении больных анкилозирующим спондилитом) за 12-недельный период терапии Найзилатом в дозе от 1800 до 600 мг/сут ни у одного из пациентов не было зарегистрировано возникновения стенокардии, фатального или нефатального инфаркта миокарда, внезапной коронарной смерти, острого нарушения мозгового кровообращения [11].
Пациенту был рекомендован прием Найзилата в дозе 600 мг 2 р./сут, до еды. Нежелательных явлений со стороны ЖКТ не отмечалось. На фоне приема Найзилата явления артрита были купированы, и пациент продолжил титрацию дозы аллопуринола до целевых значений уровня МК.
Кардиологом была проведена коррекция антигипертензивной терапии с учетом коморбидности и факторов риска, имеющихся у пациента. Была назначена фиксированная комбинация лозартана (100 мг) и амлодипина (10 мг), позволившая адекватно контролировать уровень АД.
Больной с подагрой и коморбидностью, как правило, нуждается в помощи врачей различных специальностей. Разработка стратегии лечения подобного пациента является непростой задачей и требует дифференцированного подхода, основанного на следовании современным концепциям терапии.
Оригинальная статья опубликована на сайте РМЖ (Русский медицинский журнал): http://www.rmj.ru/articles/revmatologiya/Podagra_mistifikaciya_v_stile_Gudini/#ixzz4YYML6QjK


